Forschung AK Müller
NAD(P)H-abhängige Oxidoreduktasen
Oxidoreduktasen sind in der Natur an der Biosynthese zahlreicher Naturstoffe beteiligt. Durch die stereoselektive Reduktion eines Ketons oder einer Doppelbindung kann aus einem zunächst einfachen Substrat eine komplizierte chirale Verbindung werden. Auch viele biogene Arzneistoffe wie Macrolid-Antibiotika oder ähnliche Polyketide entstehen auf diese Weise.
Nach dem Vorbild der Natur werden enzymatisch katalysierte Reduktionen auch im Labor durchgeführt. Dabei können wetvolle chirale Alkohole und andere Synthesebausteine hochselektiv durch umweltfreundliche Verfahren gewonnen werden. Die verwendeten Enzyme entstammen meist dem Metabolismus von Bakterien oder Pilzen und werden in der Regel durch molekularbiologische Verfahren gewonnen.
Die im Labor verwendeten Substanzen können eine gewisse strukturelle Ähnlichkeit zu den natürlichen Substraten der Enzyme aufweisen. Somit wird eine Auswahl erstellt, deren Enzyme für eine bestimmte Stoffklasse, einen Reaktionstyp und die gewünschte Stereoselektivität spezifisch sind. In der Arbeitsgruppe Müller kommen sowohl Alkoholdehydrogenasen als auch Reduktasen von Doppelbindungen zum Einsatz.
ThDP-abhängige Enzyme
Thiamindiphosphat (ThDP), die physiologisch aktive Form von Vitamin B1, dienst als Kofaktor der ThDP-abhängigen Enzyme und ist essentiell für deren katalytische Aktivität. ThDP besteht aus einem Aminopyrimidinring, gebunden an einen Thiazoliumring, welcher einen Phosphat Anker aufweist (Abbildung 1).
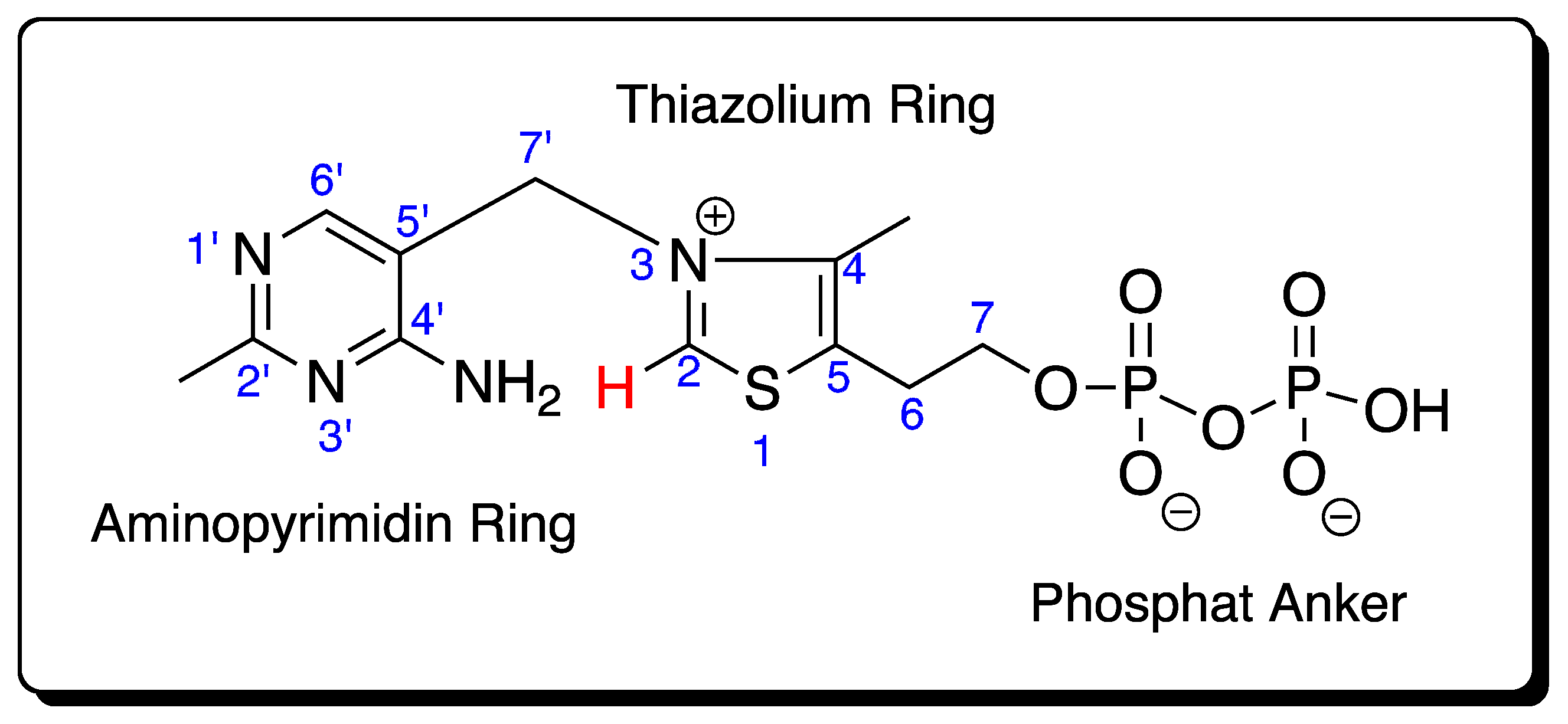
Abbildung 1: Thiamindiphosphat (ThDP)
Im ersten Schritt der Enzymkatalyse wird ThDP am C2-Atom des Thiazolium-Rings zum Ylid deprotoniert. Durch Addition des Ylids an einen Aldehyd (Donor-Substrat) wird die Aldehydfunktion des Donors in ein nucleophiles Reaktionszentrum (sog. aktivierter Aldehyd) umgepolt. Als Donor-Substrate können auch 2-Ketocarbonsäuren fungieren, die nach Anbindung an den enzymgebundenen Cofaktor ThDP decarboxyliert werden. Der aktivierte Aldehyd kann anschließend je nach Enzym auf verschiedene Elektrophile (z.B. Aldehyde) übertragen werden (Abbildung 2).
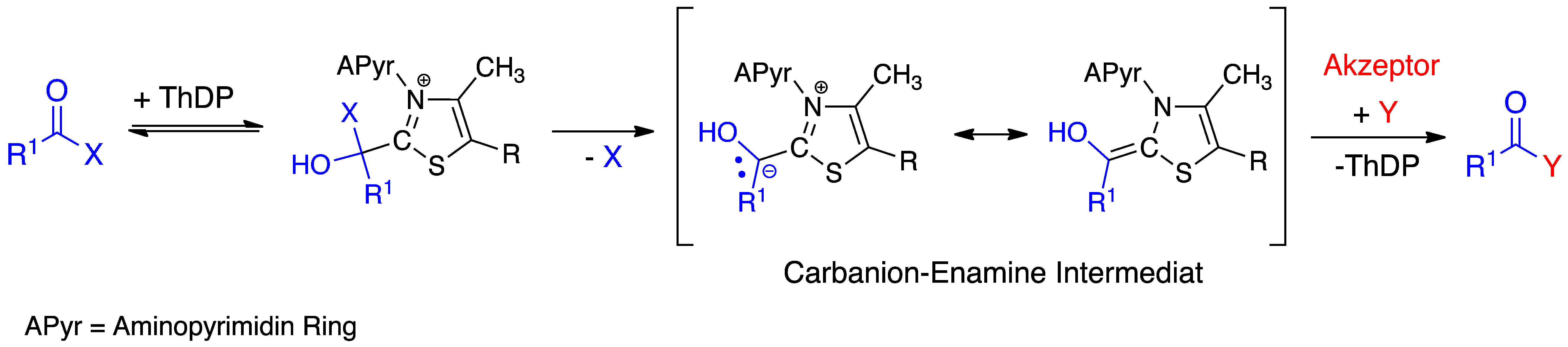
Abbildung 2: Genereller Mechanismus der Reaktion von ThDP-abhängigen Enzymen.
ThDP-abhängigen Enzyme besitzen dadurch das Potential, unterschiedliche Ligase- und Lyase-Reaktionen (z.B. die Bildung und Spaltung von C-C-, C-S-, C-N- und C-O-Bindungen) zu ermöglichen. Der Einsatz dieser Enzymklasse in der biokatalytischen Synthese eröffnet so den Zugang zu vielen wertvollen chiralen Bausteinen, deren enantioselektive Synthese in der organischen Chemie oft eine Herausforderung darstellt.
Insbesondere die C-C Knüpfungseigenschaften einer Vielfalt an ThDP-abhängigen Enzyme ist im Fokus der Forschung in unserer Gruppe als auch in den Gruppen unseren Kooperationspartnern (Abbildung 3):
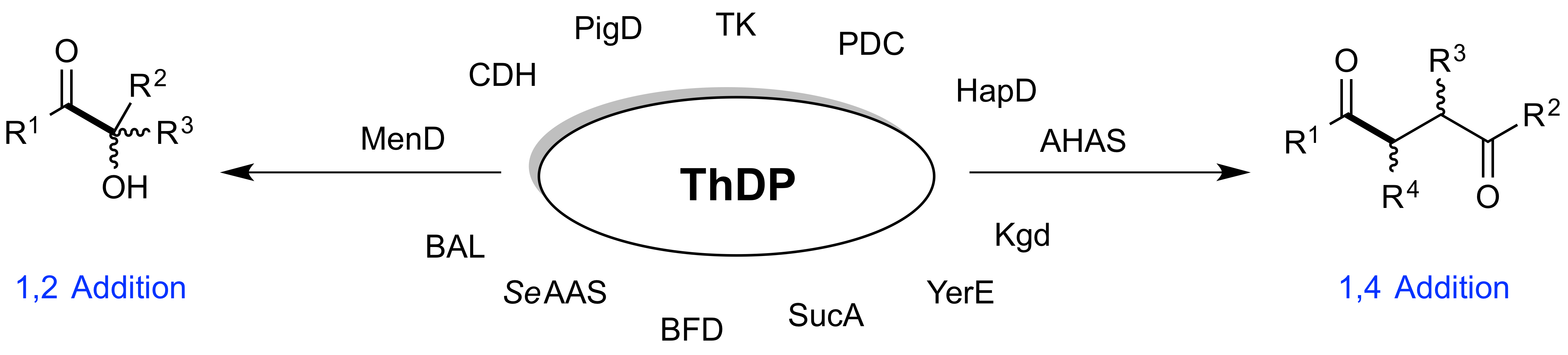
Abbildung 3: Vielfalt an verschiedenen ThDP-anhängigen Enzymen zur 1,2 und 1,4 C-C-Knüpfung.
Es wurden in unserem Arbeitskreis bereits mehrere ThDP-abhängige Enzyme kloniert, überexpremiert und im Hinblick auf ihr Potential zur asymmetrischen C-C-Bindungsknüpfung untersucht. Inbesondere die Vielfalt der ThDP-katalysierten enzymatischen Reaktionen ist beeindruckend (Abbildung 4):
Abbildung 4: Beispiele für verschiedene, durch ThDP-abhängige Enzyme katalysierte Biotransformationen.
Ziel des Projekts ist es in weiteren Arbeiten neue Carboligations-Reaktionen zu erforschen, sowie durch Mutagenese Enzymvarianten mit veränderten Eigenschaften zu generieren, um das Spektrum an wertvollen Biokatalysatoren für die Synthese zu erweitern.
Neben der der C-C-Bindungsknüpfung interessiert sich der Arbeitskreis Müller auch für die C-C-Bindungsspaltung, wie etwa im Falle der ThDP-abhängigen Cyclohexan-1,2-dion Hydrolase (CDH). Dieses Enzym ist in der Lage sowohl C-C-Bindungsknüpfungen als auch Bindungsspaltungen zu katalysieren (Abbildung 5).
Abbildung 5: CDH-katalysierte A) C-C-Bindungsspaltung und B) asymmetrische C-C-Bindungsknüpfung.
Auch beschäftigt sich unser Arbeitskreis mit der strukturellen Untersuchung und Charakterisierung dieser Enzyme. Hierzu werden die entsprechenden Enzyme kristallisiert und mittels Röntenstrukturanalyse untersucht. Dies geschieht in Kooperation etwa mit Prof. Dr. Oliver Einsle (Universität Freiburg), Prof. Dr. Susana Andrade (Universität Freiburg) und Prof. Gunter Schneider (Karolinska Institut, Stockholm, Schweden).
DFG-Forschergruppe FOR 1296 "Diversity of Asymmetric Thiamine Catalysis"
Oxidative Phenolkupplung
In Pflanzen, Bakterien und Pilzen existiert eine große Vielfalt an regio- und stereoselektiv gekuppelten dimeren Verbindungen, die eine bemerkenswerte Diversität optisch aktiver Biaryle mit sich bringt. Darüber hinaus sind Biarylverbindungen wichtige Substanzen in der organischen Synthese. Sie werden zum Beispiel als Liganden in der asymmetrischen Katalyse verwendet oder dienen als vielseitige Auxiliare in der enantioselektiven Synthese. Die Vermutung, dass die Biosynthese von Biarylen über eine Oxidative Phenolkupplung verläuft, ist mittlerweile für eine Reihe von Sekundärmetaboliten aus Pflanzen, Pilzen und Bakterien bestätigt worden. Es gilt als erwiesen, dass biosynthetisch erzeugte phenolische Verbindungen dazu tendieren über einen radikalischen Mechanismus zu dimerisieren, was eine ungeheure Mannigfaltigkeit von Biarylverbindungen mit großer struktureller Diversität zur Folge hat (Abb. 1). Bislang ist jedoch weitgehend unklar, wie die Selektivität bei diesem Schritt zustande kommt.
Abbildung 1: Oxidative Phenolkupplung; Bildung von Biarylverbindungen über mesomeriestabilisierte Phenoxyradikale
In Pflanzen ist die Oxidative Phenolkupplung am weitgehendsten untersucht. Die Biosynthesewege von verschiedenen Alkaloiden, Ligninen, Lignanen und Ellagitanninen konnte aufgeklärt werden. So untersuchten Lewis und Kollegen zum Beispiel die Kontrolle der selektiven Dimerisierung von Monolignolen in Forsythia sp. (Davin et al., 1997). Ihnen gelang es ein Protein zu identifizieren, das für die selektive Kupplung von E-Koniferylalkohol zu (+)-Pinoresinol verantwortlich ist. Der erste Schritt dieser Reaktion wird durch eine Laccase als Oxidationsmittel, der zweite Schritt durch ein dirigierendes Protein katalysiert, welches die Selektivität der Kupplung bedingt.
Abbildung 2: Selektive Kupplung von E-coniferylalkohol zu (+)-Pinoresinol
Die regioselektive Oxidative Phenolkupplung von Korupensamin A zu Michellamin A in Ancistrocladus sp. und Tripophyllum sp. wurde von Bringmann und Kollegen aufgeklärt. Hier ist es vermutlich eine NADPH abhängige Peroxidase mit hoher Substratspezifität, die eine regioselektive Dimerisierung des Naphthylisochinolalkaloids katalysiert.
Abbildung 3: Intermolekulare, oxidative Phenolkupplung von Korupensamin A zu Michellamin A
katalysiert durch eine putative Peroxidase
In Bakterien und Pilzen ist die intermolekulare Oxidative Phenolkupplung weniger gut untersucht.
Sekundäre Metabolite aus Bakterien weisen auch axiale chirale Phenolkopplungsprodukte auf. In der Vancomycin Biosynthese konnte die Herkunft zweier Biaryletherbrücken auf eine intramolekulare Phenolkupplung, katalysiert durch ein Cytochrom P450 homologes Enzym, zurückgeführt werden (Hubbard and Wals, 2003). Andere Metaboliten wie Flaviollin (Zhao et al., 2005) und Actinorhodin (Gorstallmann et al., 1981; Hopwood, 1997) aus Streptomyces coelicolor A3(2) weisen ebenfalls auf eine Phenolkupplung als Ursprung der Biarylachse hin.
Im Vergleich zur Natur, in der Biarylverbindungen meist in einem Schritt mit einer hohen Regio- und Stereoselektivität synthetisiert werden, sind die organisch-chemischen Synthesen dieser Substanzen oft sehr aufwendig, teuer und nur wenig effektiv.
Somit könnten enzymatische oder allgemeiner biokatalytische Systeme, welche die regio- und stereoselektive Bildung von axial-chiralen Biarylverbindungen katalysieren, eine äußerst hilfreiche Ergänzung und Verbesserung zu den bisher bekannten chemischen Verfahren darstellen.
Ziel dieses Projektes ist es, mit Hilfe von molekularbiologischen, biochemischen und analytschen Methoden, biokatalytische Systeme, die eine regio- und stereoselektive intermolekulare Oxidative Phenolkupplung katalysieren, zu identifizieren und zu charakterisieren. Als Modellsystem dient zum einen die Biarylverbindungen Kotanin aus dem Ascomyceten Aspergillus niger. Zum anderen wurden die polyketidischen Biarylnaturstoffe Julichrome Q3-3 aus Streptomyces afghaniensis und Setomimycin aus Streptomyces aurantiacus ausgewählt.

